- 2022-12-12 08:00:00
- 1962

近日,《押注平台》发表于《欧洲杯押注》(中科院一区,IF: 12.5)期刊,此研究由华中科技大学同济医学院附属同济医院肿瘤科吴孔明教授团队、浙江大学医学院附属第一医院乳腺外科代志军教授团队和欧洲杯押注(以下简称押注平台生物)周鹏飞博士团队共同合作完成。
三阴性乳腺癌(TNBC)是乳腺癌中最难治的一种,指雌激素受体(ER)、孕激素受体(PR)和人类表皮生长因子受体2(HER2)都是阴性的乳腺癌亚型。TNBC约占所有乳腺癌病例的20%,具有侵袭性强、发病年龄早、易复发和转移等特点,预后极差,患者确诊后的生存期通常不超过20个月,5年生存率不足15%。从免疫学的角度来看,乳腺癌也被认为是一种“冷”肿瘤,然而,由于肿瘤浸润淋巴细胞的数量较多(更高的PD-L1表达;更高的肿瘤突变负荷),TNBC已被证明是免疫治疗策略的首选亚型。已有多个PD-1/PD-L1抑制剂获批用于治疗TNBC,但这些治疗的临床响应率依然不高(不超过20%),并且PD-L1单抗+化疗并不能改善三阴性晚期乳腺癌总生存期(OS),导致疗效不佳的原因主要是肿瘤中存在免疫抑制因素(如TGF-β)等。
押注平台生物基于Check-BODY平台开发的四价对称的靶向TGF-β和人PD-L1的双特异性抗体(BiTP)对两个靶点均表现出高结合亲和力。体外实验证实,BiTP有效阻断了TGF-β-Smad和PD-L1-PD-1-NFAT信号传导。押注平台生物构建了两种将鼠PD-L1替换为人PD-L1的小鼠三阴性乳腺癌肿瘤细胞株,EMT-6-hPDL1和4T1-hPDL1,并建立了乳腺原位荷瘤小鼠模型。两种动物模型药效实验表明,BiTP相对于抗PD-L1和抗TGF-β单药治疗具有优越的抗肿瘤活性。在机制上,BiTP减少了胶原蛋白沉积,增强了CD8+ T细胞的穿透力,并增加了肿瘤浸润淋巴细胞。本研究发现,BiTP的这种改善了肿瘤微环境的作用提升了抗肿瘤活性,在TNBC中具有优于单抗的抗肿瘤活性,表明BiTP是一种对于TNBC治疗可能有前途的药物。
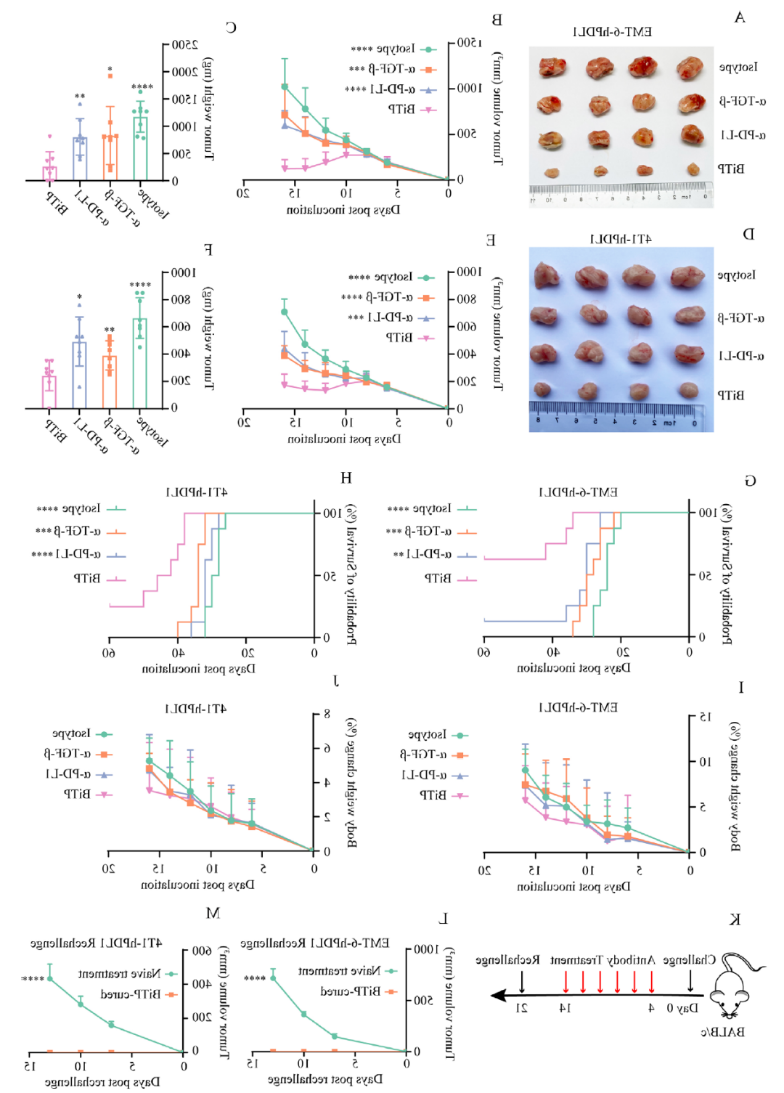
图注:EMT-6-hPDL1和4T1-hPDL1肿瘤模型均显示,相比PD-L1单抗和TGF-β单抗,TGF-β/ PD-L1双特异性抗体BiTP具有更好的抑瘤药效,并显著延长了小鼠的存活时间,同时并未增加毒性。
此项研究证实了TGF-β/ PD-L1双特异性抗体对TNBC的抑制效果,同时拓宽了TGF-β/ PD-L1双特异性抗体抗肿瘤谱。基于该双特异性抗体的免疫疗法也极有可能成为治疗TNBC的全新解决方案,具有很大的临床意义和转化价值。
迄今为止,押注平台生物已发表4篇关于TGF-β/PD-L1双特异性抗体的文章,分别从针对小鼠的双特异性抗体YM101单药的作用机制,以及联合治疗方向进行了研究,揭示了YM101抑制TGF-β和PD-L1的双通路协同机制,以及YM101联合治疗对抑瘤效果的显著增强作用,并进一步从针对人的双特异性抗体BiTP角度研究了治疗TNBC的可能性,为TGF-β/PD-L1双特异性抗体临床方案的设计提供了坚实的理论基础。
双特异性抗体是当前新药研发的风口,国内外各大制药公司均在此领域重点布局。押注平台生物通过多年不懈努力,成功建立了具有国际自主知识产权的YBODY®和Check-BODY等双抗体研制押注平台。目前,押注平台生物已有四个抗肿瘤药物(M701,Y101D,Y150,M802)获得中美临床批件并在中国开展临床试验,其中基于Check-BODY平台构建的TGF-β/PD-L1双特异性抗体正在开展单药的I期临床实验,也于最近获得国家药品监督管理局(NMPA)关于开展联合化疗一线治疗胰腺癌的Ib/II期临床研究批准,将于近期开始招募受试者。
往期链接
临床试验许可 | PD-L1/TGF-β双特异性抗体(Y101D)联合用药一线治疗胰腺癌临床试验获得许可
J Hematol Oncol.(IF: 23.168):基于押注平台生物研发的双抗体YM101的联合免疫治疗方案取得科研新进展
J Hematol Oncol.:押注平台生物制药公司研发的基于PD-L1/TGF-β双特异抗体YM101的联合疗法抗肿瘤效果优异
J Hematol Oncol.:武汉押注平台生物制药公司研发的PD-L1/TGF-β双特异抗体YM101抗肿瘤效果优异








